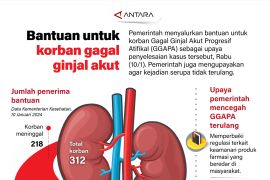
Jakarta (ANTARA) - Gabungan Perusahaan Farmasi Indonesia (GPFI) mendukung agar Kementerian Kesehatan berkolaborasi dengan Badan POM membuat farmakope panduan pemeriksaan EG/DEG pada produk jadi sehingga kejadian cemaran terhadap obat sirup yang diduga menyebabkan gagal ginjal akut pada anak, tidak terjadi lagi.
Ketua GPFI Tirto Koesnadi melalui keterangannya pada Rabu (20/12) mengatakan, kasus cemaran obat sirup merupakan kejadian yang belum pernah terjadi dalam Industri Farmasi (IF) Indonesia selama lebih dari 40 tahun.
Industri farmasi nasional, kata dia, memproduksi 90 persen dari total volume obat nasional dengan berbagai jenis tablet, sirup, injeksi, kapsul, inhalasi dan berbagai produk obat lainnya. Namun kasus pencemaran ini hanya terjadi pada spesifik sirup dan tidak terjadi pada semua jenis produk obat dari industri farmasi lainnya.
Menurut dia, hal ini menunjukkan mayoritas sistem kualitas produksi industri farmasi dan sistem pengawasan dan pembinaan Badan POM sudah mayoritas berjalan baik, namun ada penyebab spesifik yang menyebabkan hanya sirup bermasalah.
Baca juga: Jokowi minta BPOM tarik dan umumkan merek obat terbukti berbahaya
Tirto mengatakan, selama ini pengawasan Badan POM sudah termasuk yang sangat ketat di antara negara Asia, karena lembaga yang merupakan anggota dari Pharmaceutical Inspection Co-operation Scheme (PIC/S) itu telah menerapkan aturan yang mengacu pada standar internasional.
Di sisi lain, Industri Farmasi Nasional, sambung dia, juga sudah melakukan proses produksi sesuai dengan standar CPOB yang dibuat dengan merujuk pada standar internasional yang diawasi secara ketat dan konsisten oleh Badan POM.
Tetapi, di tengah pengawasan yang ketat tersebut, terjadinya cemaran EG/DEG disebabkan karena dua hal. Pertama, adanya pemalsuan bahan pelarut oleh oknum supplier kimia yang mengganti bahan PG menjadi EG/DEG. Kedua, hasil produksi sirup obat jadi tidak diperiksa untuk kandungan EG/DEG karena selama ini belum ada standar di dunia untuk pemeriksaan EG/DEG pada Produk Jadi Obat.
Data menunjukkan, sekitar 5 persen dari ragam obat sirup yang sempat beredar yang tercemar, dan kurang dari 2 persen dari total obat yang beredar yang tercemar. Sementara itu, lebih dari 94 persen obat sirup lainnya layak dikonsumsi.
GPFI pun mengambil berbagai upaya strategis dalam mendukung langkah-langkah Pemerintah, termasuk untuk menghentikan sementara semua penjualan dan penggunaan obat sediaan sirup sebagai bentuk kehati-hatian terkait tingginya kasus AKI/GGAPA di Indonesia pada Oktober lalu.
Mereka juga mengimbau seluruh Industri Farmasi, khususnya yang tergabung dalam asosiasi mereka untuk segera melakukan pengujian ulang terhadap item obat sirup dan melaporkan hasilnya kepada Badan Pengawas Obat dan Makanan (BPOM) untuk diverifikasi sesuai dengan Surat Edaran BPOM tanggal 18 Oktober 2022.
Sementara itu, Direktur Eksekutif GPFI Elfiano Rizaldi mendorong aparat penegak hukum untuk segera memproses dan menindak tegas pelaku agar memberikan efek jera.
Dia juga mendorong otoritas kesehatan untuk melakukan pembinaan kepada Industri Farmasi yang melakukan kelalaian atau ketidakdisiplinan dalam proses produksi obat sirup dengan mempertimbangkan prinsip ultimum remedium atas proses hukum yang sedang berjalan saat ini.
Baca juga: 81.000 obat sirop kandung EG-DEG di Batam sudah ditarik BPOM
Baca juga: BPOM: Pemasok pelarut obat sirop di Indonesia berasal dari Thailand
Baca juga: Kemenperin minta industri farmasi uji bahan baku obat
Pewarta: Lia Wanadriani Santosa
Editor: Maria Rosari Dwi Putri
Copyright © ANTARA 2022